Introducción a la ingeniería industrial/Química/Estequiometría
La estequiometria estudia las combinaciones atómicas de las reacciones químicas. Sigue un único principio: la materia ni se crea ni se destruye, por tanto, en una reacción, los átomos hallados a un lado han ser iguales a los hallados al otro. Por ejemplo:
La ecuación química está equilibrada ya que hay 2 nitrógenos y 6 hidrógenos a cada lado.
Los balances de materia intervienen con esquemas de reactores y, utilizando la estequiometria, nos permiten deducir el comportamiento de un sistema de reactores.
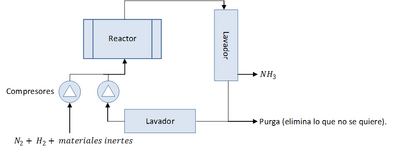
El proceso de Habber-Bosch simplificado (el de producción del amoniaco) sería:
El proceso se resume así en una línea de entrada (A) que se mezcla con otra entrada (R) de la cual hablaremos después dando lugar a B. B entra en el reactor y sale como C que se divide en E y en X, siendo X el producto final. E se divide a su vez en P, la purga, y R, el recirculamiento, que vuelve al principio. Se explicarán como calcular estos sistemas.
- Nota: este es un tema puramente práctico y que se explicará con ejemplos prácticos.
Ley de conservación de la materia
editarEl químico francés Antoine Lavoisier, formuló la ley más importante de la estequiometría, y una de las grandes leyes de la química. La materia ni se crea ni se destruye, sólo se transforma. Esto qué significa. Hasta entonces, cuando se quemaba algo, los químicos notaban que la masa desaparecía (en realidad se desprendían gases) lo cual tomaron como indicativo de que la materia estaba siendo destruida. Lavoisier contradijo esta creencia, haciendo posible el desarrollo de la química en este aspecto.
Es posible, sin embargo, aniquilar materia con grandes concentraciones de energía (transformar materia en energía) pero eso es parte de la física y, al nivel al que se trabaja en los experimentos cotidianos (en los cuales los aceleradores de partículas no tienen cabida) esta ley se sigue cumplendo a la perfección.
Ajuste de ecuaciones
editarSiguiendo la ley de conservación de la materia, en cualquier reacción física se cumple que los átomos que entran son los mismos que los átomos que salen. De esta forma podemos ajustar reacciones químicas.
Por ejemplo, empezaremos con algo simple:
Por lo general se empieza ajustando por los compuestos con más de un tipo de átomo. En este caso empezamos con el H2O.
- A la izquierda de la ecuación hay 2 hidrógenos. A la derecha de la ecuación hay 2 hidrógenos.
- A la izuqierda de la ecuación hay 2 oxígenos. A la derecha de la ecuación hay 1 oxígeno.
Así está ajustada la ecuación, pero es posible que nos interese tener todos los coeficientes enteros:
Otro ejemplo un poco más complicado (es una combustión):
- Los carbonos están igualados, pero tenemos el doble de hidrógenos a la izquierda que a la derecha:
- Por último, ajustamos los oxígenos. Hay 2 a la izquierda y 4 a la derecha (2 del CO2 y 2 de los dos H2O).
Y ya tenemos la reacción ajustada.
Ajuste de ecuaciones con iones
editarSi además de compuestos, en nuestra reacción tenemos iones, hemos de ajustar no sólo los átomos, sino también las cargas. Se pueden añadir electrones para suplir la ausencia de los mismos, o incluso algunos compuestos (protones o H+, agua...).
Por ejemplo:
- Lo primero que vemos es que los átomos están ajustados. Ahora hay que ajustar las cargas. A la derecha hay 1+ (de la plata), y a la derecha 2+ (del cinc).
Y con esto hemos ajustado una reacción sencilla con iones.
Más ejemplos
editar| Reacción sin ajustar | Reacción ajustada |
|---|---|
| Se deben añadir más ejemplos... | ...con sus respectivas soluciones |
La combustión
editarEs posible que este dato se conozca, pero una combustión siempre se genera con algún compuesto con carbono y oxígeno (aire), y produce CO2 y agua o CO y agua si hay falta de oxígeno. Por ejemplo, la glucosa quema en:
- (suficiente oxígeno, combustión completa)
- (insuficiente oxígeno, combustión incompleta)
Estas reacciones están ajustadas. 6 carbonos, 12 hidrógenos y 18/12 oxígenos a cada lado. Es muy común que nos indiquen que no se usa oxígeno para realizar la combustión sino que se usa aire. Generalmente se daría la composición del aire. Si no, es aproximada mente 21% de oxígeno, O2, y 79% de nitrógeno , N2, (existen otros gases en menores cantidades que no contamos). Lo normal es que el aire sea seco, pero si nos dicen lo contrario hemos de añadir el volumen de vapor de agua requerido. Por ejemplo, nos dicen que tiene una humedad del 20%, eso es que el 20% es agua, mientras que el 80% es la proporción 79/21 de nitrógeno/oxígeno (por si no se conoce como se calcula eso, el 79% del 80% es 0.79•80%). Entonces si necesitamos usar aire (y no oxígeno puro), ¿Cómo se hace? El siguiente método es suficientemente simple:
- Calculamos la estequiometria como si sólo usáramos oxígeno
- Ese oxígeno es el 21% del aire (entonces dividimos los moles de oxígeno entre 0.21 para hallar el volumen de aire) y el nitrógeno que necesitamos es el 79% de ese aire (multiplicamos el volumen de aire por 0.79). Es posible que nos den otros valores, por ejemplo Nitrógeno 80%, oxígeno 20%. En este caso usamos los datos que nos den.
El nitrógeno (que no reacciona con nada, ya que es muy poco reactivo) se suma delante y detrás de la ecuación (aunque parezca poco útil, se hace así, y evita problemas cuando se calculen volúmenes de gases). Para ilustrar usamos el ejemplo de la glucosa, vamos a quemar 1 mol de glucosa (son 180 gramos de azúcar aproximadamente):
Otro problema sería ¿qué pasa si nos dicen que hay un exceso de aire del 20%?
- Calculamos la estequiometria como si sólo usáramos el oxígeno que necesitamos. Téngase en cuenta que si tenemos exceso de aire nunca podremos tener CO.
- Le sumamos el exceso de O2. Si tenemos 9 moles de oxígeno y un exceso del 20% entonces a esas 9 moles de oxígeno se le suman 1.8 moles más.
× 0.80 × 0.20
- Le sumamos el nitrógeno que se necesita para ese exceso de aire (exactamente igual que antes, pero en vez de tomar 9 moles de O2 tomamos 10.8).
Aún es posible complicarlo más, imaginemos que no tenemos el aire necesario para realizar una combustión completa, pero no tan poco como para que se produzca una combustión totalmente de CO. Entonces tenemos una combustión parcial (produce CO2 y CO en proporciones que deberían de ser indicadas de alguna manera). En tal caso hemos de hacer las reacciones de combustión completa e incompleta, y multiplicarlas por el porcentaje en que saldrán. Por ejemplo quemamos 1 mol de azúcar con aire tal que el 20% tiene combustión incompleta y el 80% combustión completa (en estos problemas nunca puede haber exceso de aire ya que no tendría sentido).
× 0.8 × 0.2
A esto se le puede sumar el nitrógeno sin ningún problema. Si hay una parte no reactiva (por ejemplo el 20% se quema en CO, el 70% se quema en CO2 y el 10% restante no reacciona por cualquier motivo) entonces se aplica algo similar:
× 0.1 × 0.7 × 0.2
Balances de materia
editarLos balances de materia consisten en equilbirios lógicos entre lo que entra en un sistema y lo que sale (que debe ser equivalente en masa según indica el principio de Lavoisier de conservación de la masa).
Los balances pueden representar mezclas (o separaciones) de materiales (pintura, o depuraciones de agua) o reacciones químicas. Si se refiere a mezclas de materiales la equivalencia entre lo que sale y lo que entra se puede considerar en moles o volumen. Por supuesto siempre se podrá utilizar la equivalencia de masas.
En resumen el principio es simple. Lo que entra tiene que salir por algún lado, ya que, ni se destruye la materia, ni tenemos reactores con capacidad infinita.
Balances simples
editarVamos a comenzar con balances simples. En estos no aparecerá ni purga ni recirculación. Este tipo de balances pueden ser tan simples como ajustar una ecuación (en caso de que haya reacciones químicas) o hacer equivalencias (en caso de mezclas). Su esquema es el siguiente:
Podemos deducir que la masa (o las moles y volumen si no hay reacciones químicas) que entran (A) es igual a los que salen por (X).
También es posible que sean algo más complicados, incluyendo varias entradas y una salida, una entrada y varias salidas, o incluso varias salidas y varias entradas. Generalmente las combustiones tienen dos entradas y no son complicados (tienen una entrada para el material a quemar y otra para el aire).
Faltan ejemplos
Balances con recirculación
editarLos balances con recirculación se usan especialmente cuando los procesos empleados no tienen un rendimiento muy alto. En el universo ideal que suelen plantear en los problemas, la existencia de procesos con rendimiento 100% es posible, pero en la realidad no es asi y es muy común encontrar la recirculación y purga en los reactores. De esta manera se separa el producto de los materiales sin reaccionar (por ejemplo en el diagrama del amoniaco del principio del tema) y este material sin reaccionar retorna al circuito para que reaccione. Este sistema sigue el siguiente esquema:
En un reactor real, se tiene que cumplir que la cantidad de matria que entra tiene que ser igual a la que sale, por tanto se cumple:
- A = X
- B = C
- B = A + R (R no puede ser 0 ya que no tendría sentido)
- C = X + R (esta ecuación es combinación de las anteriories)
Estas ecuaciones debemos tenerlas en cuenta cuando hagamos problemas de estos ya que son las que los solucionan.
Faltan ejemplos
Balances con recirculación y purga
editarEjercicios con recirculación sin purga hay pocos, ya que no hay materias puras, y si se fuera mandando lo que no reacciona al reactor una y otra vez, nos lo encontraríamos lleno de materiales inertes, aparte de colapsar el sistema. Por tanto debemos considerar la purga en un ejercicio con recirculación (siempre que indiquen que hay purga, que es bastante común).
Ahora el esquema se complica un poco. Ya no podemos decir que A = X, ya que existe otro conducto de salida, P.
- A = X + P
- B = C
- B = A + R
- C = E + X
- E = R + P
Con estas ecuaciones es posible hacer los problemas con purga.
Un par de aclaraciones:
- Por lo general la purga no filtra lo que extrae, sino que extrae parte de lo que pasa por E de forma indiscriminada (es decir, no considera si es material inerte o si es material útil). Si se pudiera hacer se haría antes del proceso y se simplificaría la máquina.
- A diferencia de la purga, la recirculación si es capaz de filtrar lo útil de lo que puede ser recirculado (como es un material distinto, ya que ha reaccionado, se puede separar por diversos métodos).
Faltan ejemplos
Para qué se usa cada uno
editarLos balances simples son usados especialmente en mezclas y en combustiones, es decir, procesos que no son muy complejos o que no importa la pureza del resultado (en el caso de las combustiones es muy probable que se intente obtener energía).
Los balances con recirculación son usados cuando la reacción no tiene un rendimiento alto (o se desea obtener un producto muy puro), pero los materiales son suficientemente puros.
Los balances con recirculación y purga se usan cuando se tiene que hacer recirculación, pero existen impurezas que no reaccionan. Si no se van filtrando la máquina se terminaría colapsando.
Para explicar esto podemos imaginar que tenemos un compuesto que va a reaccionar que

